摘要
据报道,火山每年通过喷发、喷气孔或弥漫的土壤脱气释放出数吨汞和其他重金属。由于世界上很大一部分人口生活在活火山附近,本研究的目的是评估这些金属在中枢神经系统中的积累以及金属硫蛋白等重金属解毒的细胞机制的存在。为了开展这项研究,在Furnas村(葡萄牙亚速尔群岛)捕获长期暴露于活火山环境的野生小鼠(小家鼠),并与在参考区域(葡萄牙亚速尔群岛Rabo de Peixe)捕获的野生小鼠进行比较。一方面,通过ICP-MS和汞分析仪分析脑和小脑来评估重金属负荷,另一方面,通过免疫荧光法研究金属硫蛋白2A的存在。我们的研究结果显示,与未暴露的个体相比,暴露小鼠中枢神经系统中汞、镉和铅等金属的负荷更高,此外,大脑和小脑不同区域的金属硫蛋白2A的免疫反应性更高,表明可能存在神经保护过程。
介绍
人类和火山在地理上的共存是一个日益增长的趋势。目前,据估计,世界上14.3%的人口生活在活火山附近,因为从活火山获得的好处:土壤肥力,旅游吸引力或地热资源的使用(Kelman & Mather, 2008;Linhares et al., 2015;Sigurdsson et al., 2015)。然而,居住在这些环境中会给人类带来风险,这些风险并不总是与爆炸活动有关。火山是一种地质构造,即使在不活动或灭绝时,也会向大气中释放有毒气体或重金属等对人类健康有害的污染物(Bagnato等人,2018;Ferreira etal ., 2005),汞是释放的主要金属之一(Edwards etal ., 2021;Gustin et al., 2008;《,2009)。在自然界中,汞以三种不同的形式存在:水蒸气汞或单质汞(气态单质汞,GEM或Hg0)、无机汞(I-Hg)和甲基汞(MeHg)。大气中大于90%的汞由GEM构成,由火山系统和人为排放等自然来源释放(Liu et al., 2012a, 2012b)。由于其稳定性,它留在大气中,可以被氧化成Hg+2 (Holmes et al., 2006),这种I-Hg形式主要通过工业过程释放到大气中(Li & Tse, 2015),并沉积在土地和水中。在那里,i -汞可以甲基化,产生有机形式的甲基汞,其更令人担忧的命运是其在水生生物或构成人类食物的植物中的生物积累(Selin, 2009)。气体形式可能是火山环境中居民进入生物体的主要途径(Camarinho et al., 2021)。
最近的估计表明,火山每年释放45至700吨汞,不仅通过喷发,而且通过喷气孔或弥漫的排气带(Pyle & Mather, 2003年)。Nriagu和Becker(2003)估计,全球火山喷发产生的汞通量为57 t/年,而脱气活动产生的通量为37.6 t/年。在圣米格尔岛(葡萄牙亚速尔群岛),火山活动通过热液表现明显,如冷CO2和温泉、地面脱气和喷气孔场。岛上最大的扩散脱气区位于furas村,这是一个位于furas火山火山口的人类定居点,furas火山是岛上三座活火山之一,与Fogo和Sete Cidades一起。由于不断释放大量的气体和气溶胶,生活在这些排气区对居民的健康构成最大的危害之一;根据Viveiros等人(2010)的研究,福纳斯火山每天排放968吨二氧化碳。人们还研究了这座火山以气态形式排放的汞。Bagnato等人(2018)计算得出,Furnas火山在0.04 km2的面积上排放了9.6 × 10-5 t d - 1。考虑到陨石坑的尺寸是7 × 6公里,每天释放的汞蒸气量要高得多。因此,除其他污染物外,这一人群的居民可能因长期接触这种金属而遭受健康影响。
气态元素汞已被证明能够穿过血脑屏障(BBB)和胎盘屏障(Pamphlett等人,2019;Solan & Lindow, 2014),并且暴露于这种重金属与神经退行性疾病的发展有关(Bittencourt等人,2022;Carocci et al., 2014;Corrêa等人,2020;Farina et al., 2013;Luisetto等人,2019)。它易于跨越不同的细胞屏障是由于它的脂溶性,这也允许Hg0穿过质膜,以I-Hg的形式在细胞内积累(Cariccio等人,2019)。文献报道,这种形式的汞诱导活性氧(ROS)的产生(arag
细胞减少ROS生成的一种机制是金属硫蛋白(MTs),这是一种低分子量蛋白质,负责调节必需和非必需金属的浓度,如镉(II)、汞(I、II)和铅(II),以及铜(II)和锌(II)的体内平衡(Martinez-Finley etal ., 2012)。在氧化应激的情况下,MTs通过核孔迅速转移到细胞核,在核孔中被氧化并运输回细胞质(Nzengue et al., 2009)。该系统似乎参与保护细胞免受遗传物质的损害和细胞凋亡。
在哺乳动物中,已鉴定出四种名为MT-I至MT-IV的同种异构体,其中MT-I和MT-II(称为MT-2A)分布最广泛;它们在不同组织的多种细胞类型中表达(Babula et al., 2012)。在中枢神经系统中,MT-I/II和MT-III亚型不仅具有不同的表达模式,而且对不同的威胁作出反应,MT-I/II亚型在中枢神经系统对损伤的整体反应中发挥着重要作用,尽管这种反应很微妙(West et al., 2008)。MT-I/II位于小脑和脊髓中,主要在星形胶质细胞中表达,特别是那些采用反应形式的星形胶质细胞(Hidalgo et al., 2001)。
金属解毒作为mt的主要功能已经在体内得到了广泛的研究(Kehrig等人,2016;Montaser et al., 2010;Siscar et al., 2014;Yuvaraj et al., 2021)和体外(Hwang et al., 2013;Pirzadeh & Shahpiri, 2016;Qu & Waalkes, 2015;Shahpiri & Mohammadzadeh, 2018),这些金属蛋白的所有同种异构体已经被认为是抗氧化元素。
我们之前的研究报道,长期暴露于火山污染物的小鼠在中枢神经系统、大脑和脊髓的不同区域,包括海马齿状回某些类型神经元的细胞内水平(Navarro-Sempere et al., 2021b)和腰腹角运动神经元(Navarro-Sempere et al., 2022)中表现出无机形式的汞积累。此外,在相同的海马体区域也发现了胶质细胞群的变化,如星形胶质细胞或小胶质细胞。在星形胶质细胞方面,这些动物显示出这些细胞的活性形式增加,星形胶质细胞功能障碍与谷氨酰胺合成酶减少有关(Navarro et al., 2021)。另一方面,这些动物的小胶质细胞数量也增加了,并且在海马的同一区域发现了反应性小胶质细胞。同样,我们还观察到齿状回亚颗粒区以及多态区一些神经元内促炎细胞因子TNFα的增加(Navarro-Sempere等,2021a)。
这些先前的结果表明,由于长期暴露于火山污染物造成的神经毒性,这些小鼠的中枢神经系统正在发生神经炎症事件。虽然无机汞在中枢神经系统中的存在已在以前的研究中得到证实,但它尚未被量化。此外,火山释放的其他化合物会积聚在中枢神经系统中,造成其他影响。
最后,我们的主要目标是首次定量分析长期暴露于活火山环境的小鼠中枢神经系统中有哪些元素积累,并了解这些暴露的生物体是否表现出金属硫蛋白,特别是异构体II的表达增加,金属硫蛋白在中枢神经系统的抗氧化、抗凋亡和抗炎症过程中发挥重要作用。
材料与方法
研究区域和动物收集
本研究以小家鼠(Linnaeus, 1758)为替代种。在圣米格尔岛的两个不同地点捕获了两组野生老鼠,小家鼠。其中一组在有活火山活动的Furnas村(暴露组)被俘,另一组在没有活火山活动的Rabo de Peixe小村被俘(参照组)。两个地点相距24公里。弗纳斯村有1500名居民,有活火山活动的迹象,如喷气孔田、二氧化碳热液泉和明显的土壤脱气现象,这些现象导致挥发性金属和其他气体不断进入大气。Rabo de Peixe是一个拥有5000名居民的乡村,自17世纪以来没有活火山活动的证据,也没有主要的人为污染源。此外,Rabo de Peixe是一个沿海城镇,因此空气更新率很高。
通过放置在村庄不同地点的诱捕器捕获10只野生小家鼠(furas N = 5和Rabo de Peixe N = 5),并在尽可能短的时间内将其活体转移到实验室,在那里用异氟烷麻醉。一旦达到正确的麻醉平面,动物经心灌注盐水磷酸盐缓冲液和4% PFA溶液。灌注后,按照Navarro-Sempere等人,2021b的描述,将脑取出,用4% PFA浸泡在4°C下过夜固定。在这些大脑中,右半球被处理为光学显微镜,左半球被处理为金属量化技术。记录了所有个体的性别、体重和年龄等参数。根据qu
实验程序经亚速尔大学伦理委员会批准(REF: 10/2020)。所有程序均按照《欧洲保护实验和其他科学用途脊椎动物公约》(ETS 123)、2010/63欧盟指令和葡萄牙法令(DL 113/2013)的建议进行。
元素分析
脑样品中共监测了12种元素(Al、Cd、Co、Cr、Cu、Fe、Hg、Mn、Ni、Pb、V和Zn)。除汞外,所有元素在经过微波辅助消化处理(ultra - wave, Milestone, Italy)后,采用电感耦合等离子体质谱法(ICP-MS 8900, Agilent,美国),按照Milestone Ultrawave应用手册中的说明进行测定。为此,在石英管中用2.5 mL浓硝酸处理一定数量的样品(40-100 mg),使用生物样品推荐的消化程序。在所有情况下,消化完全,没有观察到固体残留物。接下来,将消化后的样品稀释至5ml,并使用酸基质匹配标准品进行分析。ICP-MS测定和样品消解的实验细节见表1和表2。
由于汞是一种高度挥发的物质,在样品制备过程中可能会丢失,因此在汞分析仪设备(DMA 80, Milestone, Italy)的帮助下,使用2007年美国环境保护署(EPA)描述的协议,直接在脑样品中测定该元素。在该仪器中,样品被沉积在石英船上,并在氧气存在的控制温度程序下加热。接下来,热解产物流通过催化剂和一个以金为基础的陷阱,其中汞以汞齐的形式被特别保留。最后,对捕集器进行快速加热以释放汞,并用原子吸收光谱法进行检测。在这项工作中,采用了仪器制造商推荐的标准温度程序,没有做任何进一步的修改(表3)。用这种方法检测的是氧化形式的Hg (Hg2+)。
由于没有用于痕量金属分析的脑认证参考物质(CRM),因此采用鱼蛋白CRM (DORM-3,国家研究委员会,渥太华,安大略省,加拿大)作为代理来验证方法的可追溯性和真实性。该样本在分析脑样本前后均采用上述方法进行分析,验证值差异无统计学意义(p < 0.05, 3个重复)。
组织处理和免疫荧光分析
使用显微切片机(Microm HM 340E)从测试样品的右半球获得厚度为4µm的矢状切片。为了进行免疫荧光检测,这些切片经过热介导的抗原回收,并在室温下用10% BSA封闭90分钟。然后用一抗mt - 2a抗体(DF6755, Affinity Biotech)以1:100稀释,在4°C下过夜进行免疫标记。第二天,切片清洗,用二抗(SAB4600310, Sigma Aldrich Co.)以1:500稀释,室温摇匀培养3小时。然后清洗几次,用含有DAPI的Vectashield培养基(Vector Laboratories, Burlingame CA)对细胞核进行染色。成像使用蔡司共聚焦显微镜,放大倍数为20倍。保持像素、对比度和亮度恒定,在z平面每0.5µm拍摄一张显微照片,并使用Zen Blue软件获得每张切片的正交投影。研究每个个体间隔150µm的3个矢状面切片。
统计分析
分析了福纳斯和拉博德佩克斯样品中金属浓度的差异。为此,分别对每种元素(Cd、Hg和Pb)进行了具有欧几里得距离的单向排列方差分析(PERMANOVA) (McArdle & Anderson, 2001)。此外,使用蒙特卡罗方法计算p值(Anderson, 2014)。在PRIMERv6-PERMANOVA+软件包中进行PERMANOVA (Anderson et al., 2008)。
在两个研究区域捕获的标本的年龄和体重数据使用t-Students检验进行比较,p值小于0.05认为具有统计学意义。使用Graph Pad Prism软件(Graph Pad software Inc., La Jolla, CA, USA)进行统计分析。
目录
摘要介绍
材料与方法
结果
讨论
参考文献
致谢
作者信息
道德声明
搜索
导航
#####
结果
本研究中使用的所有样本都对应于男性个体。两个研究区捕获的动物年龄差异无统计学意义(弗纳斯:234±19天,拉布·德·佩克斯:292±36天;p = 0.191,学生t检验),体重差异无统计学意义(弗氏体:15.18±1.03 g,拉布氏体:13.4±2.07 g;p = 0.124,学生t检验)。
元素分析
在furas和Rabo de Peixe的小鼠脑样品中共检测了12种元素(Al, Cd, Co, Cr, Cu, Fe, Hg, Mn, Ni, Pb, V和Zn)(表4)。观察到furas小鼠样品中Cd, Hg和Pb的含量高于Rabo de Peixe(图11 - c)。这些元素在Furnas小鼠样品中的平均浓度分别为0.22±0.09、19±6和0.5±0.3 g kg−1。然而,在Rabo de Peixe中发现的金属含量分别为0.04±0.02、8±4和0.09±0.04。无论小鼠的位置如何,汞的浓度最高,其次是Pb和Cd。furas小鼠体内的汞浓度特别高,在6.6至28µg kg - 1之间。对于Rabo de Peixe小鼠,金属含量大多低于10µg kg−1。furas和Rabo de Peixe的铅浓度范围分别为0.13 ~ 1.1和0.05 ~ 0.15µg kg−1。弗纳斯样品的镉浓度水平范围为0.10至0.40µg kg - 1,而拉布佩克斯样品的镉浓度水平范围为0.02至0.06µg kg - 1。最后,在两个地点的小鼠样本中,没有观察到金属浓度的显著差异,其余元素(Al, Co, Cr, Cu, Fe, Mn, Ni, V和Zn)。
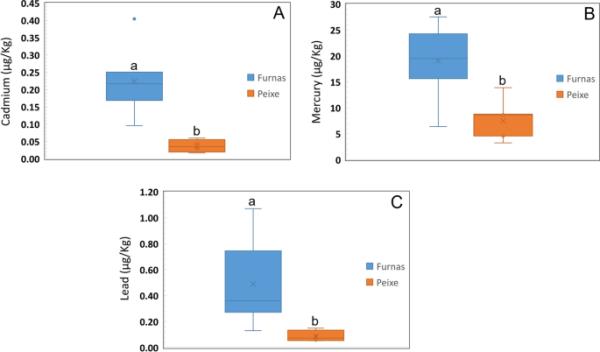
来自Furnas和Rabo de Peixe的小鼠脑中的金属浓度。Cd: Pseudo-F1,10 = 20.928, p值(MC) < 0.01 a Hg: Pseudo-F1,10 = 22.242, p值(MC) < 0.001 b Pb: Pseudo-F1,10 = 7.725, p值(MC) < 0.05 c.框内线,中位数;细竖线,最小值和最大值。条形图上不同的字母表示不同地点之间的显著差异
发现我tallothio在中枢神经系统中
在Furnas村捕获的小鼠的大脑中对MT-2A的免疫反应性高于Rabo de Peixe捕获的小鼠的大脑。特别是,免疫反应性位于海马齿状回的分子层和颗粒层。在暴露动物中,与Rabo de Peixe动物相比,在齿状回分子层和颗粒层之间的边界区域(称为亚颗粒区)和白质中观察到更高的MT-2A标记(图2a-c)。此外,在Furnas捕获的小鼠的分子层部分细胞的细胞质中也观察到MT-2A阳性标记(图2e)。长期暴露于火山污染物的动物在脑脉络膜丛、上皮细胞细胞质和血管中也显示出显著的MT-2A金属蛋白标记(图3a)。然而,在Rabo de Peixe捕获的小家鼠个体在脑脉络膜丛中几乎没有任何MT-2A标记(图3b)。
最后,来自Furnas村的动物小脑显示出强烈的MT-2A免疫反应性(图4a),特别是位于小脑或青叶的白质中,在脑膜和一些浦肯野细胞内也观察到MT-2A免疫反应性(图4c)。Rabo de Peixe小鼠小脑免疫反应性较弱(图4b)。
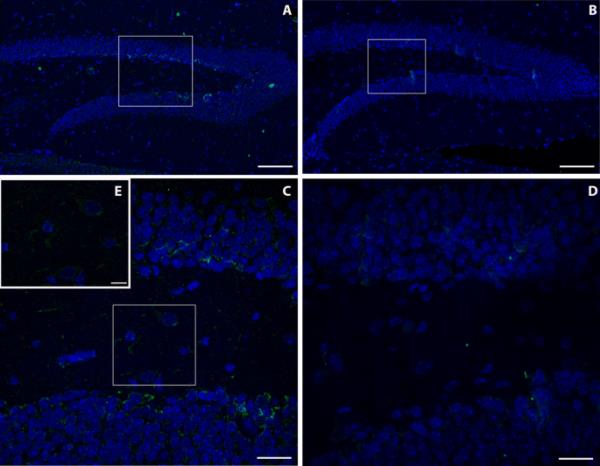
火山污染物暴露小鼠a和对照区小鼠b海马齿状回MT2A的免疫荧光检测。比尺:100µm。分别为图像(a)和(b)的放大倍数。c、d.比例尺:20µm。注意暴露动物齿状回不同细胞内MT2A阳性染色(e)。比尺:10µm
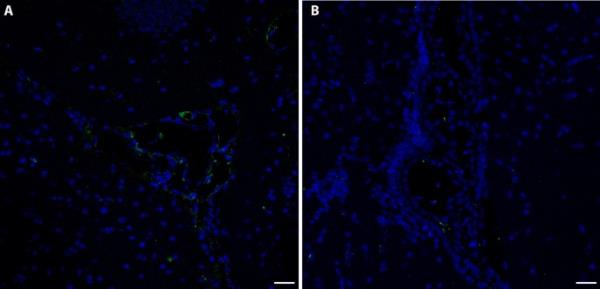
来自Furnas (a)和Rabo de Peixe (b)的小鼠脉络膜丛中存在MT2A。注意两组之间这种金属硫蛋白的表达差异。比例尺:20µm
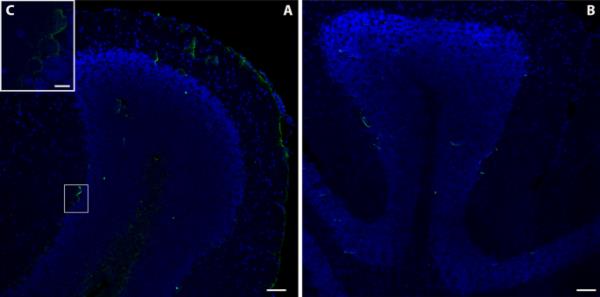
弗纳斯a和拉布·德·佩克斯b个体小脑对MT2A免疫反应的显微照片。比例尺:50µm。观察长期暴露于火山污染的动物浦肯野细胞中这种金属硫蛋白异构体的存在(c,插图)。刻度杆:10µm
讨论
目前,重金属污染是对环境的最大威胁之一,能够降低水、土壤、空气的质量,并由于金属的持久性、高毒性和生物利用度而影响人类健康(Yang etal ., 2022)。虽然这种类型的污染与人为来源密切相关,但它也可能由于自然原因而发生,包括火山活动。火山污染物,特别是来自非喷发活动的污染物,对居住在其附近的人口构成的风险被低估了。它们释放出各种可能对人类和动物健康有害的产品,引发病变,特别是在神经、呼吸和心血管系统。首次收集了长期暴露于非喷发火山环境的个体大脑中汞和其他重金属积累的定量数据。
我们的研究结果表明,圣米格尔岛上火山活动的存在是导致弗纳斯动物大脑中发现大量重金属(如汞、镉和铅)的原因,而在拉博德佩xe捕获的动物大脑中发现这些元素的细微存在,因为这两个地方都没有重工业或其他形式的人为污染的证据。至于汞,长期接触的小鼠大脑中的汞浓度比来自参考区域的动物高6倍。这一定量结果强化了我们之前的报告,其中通过自动金相技术证明了CNS不同区域中无机汞积累的存在(Navarro-Sempere等人,2021b, 2022)。我们的研究结果再次表明,大脑是汞化合物的主要目标器官之一,尤其是汞。
如上所述,气态的汞是火山系统释放的主要金属之一。Hg0通过呼吸系统进入,通过血液流动,并能穿过血脑屏障(BBB)。在细胞内,这种形式的汞通过过氧化氢酶途径被氧化为Hg2+, Hg2+被认为是这种元素的有毒形式(Aschner & Aschner, 1990;Clarkson & Magos, 2006;Fernandes Azevedo et al., 2012)。由于Hg2+不能离开细胞,它被还原回Hg2并在细胞间传递,这一过程可能涉及超氧阴离子和辅酶NADH和NADPH (Ogata et al., 1987)。
此外,在目前的研究中,我们还观察到来自参考区域的老鼠大脑中存在汞,尽管数量要少得多,可能是由于该岛自身的火山活动。
除了汞,静止火山还释放出其他重金属,如砷(as)、镉(Cd)、铝(Al)、铷(Rb)、铅(Pb)、镁(Mg)、铜(Cu)和锌(Zn)。就弗纳斯火山而言,Cd、Cu、Pb、Rb和Zn通常存在于火山排放物中,它们在弗纳斯村居民头皮中的高浓度证明了它们的高生物利用度(Amaral等人,2008年)。关于这些金属,在目前的工作中,我们的结果显示只有Pb和Cd有显著差异,在Furnas捕获的小家鼠个体的大脑中这些重金属的浓度高于参考区域的动物。正如Amaral等人(2007)指出的那样,这些重金属在小鼠体内的存在可能是由于摄入了富含这些金属的食物或土壤。然而,在那项研究中,这些动物的肺部也显示出更高的浓度,从而证实了吸入是一种进入途径。这一吸入途径也已在圣米格尔岛的动物中得到证实,特别是在福纳斯地区(Camarinho et al., 2021)。
至于铅,空气中约90%的铅颗粒被人体吸收和保留(Tokar et al., 2013)。到达肺部的铅颗粒可被常驻巨噬细胞吞噬,吞噬体内形成的酸性环境有利于pb++离子的释放。这些离子通过血流,并在钙依赖性atp酶泵的帮助下通过被动运输穿过血脑屏障(Iqubal et al., 2020)。在大脑中,这种金属主要积聚在海马体和皮层(Bradbury & Deane, 1993)。铅积累在中枢神经系统的总体影响是神经元的高兴奋性和氧化应激,这有利于神经炎症事件的发生,如小胶质细胞的激活和促炎细胞因子如一氧化氮合酶、IL-1或TNF-α的过度表达(Liu et al., 2012b)。先前的研究表明,长期暴露于火山环境会引发神经炎症反应,激活小胶质细胞并增加海马齿状回中的TNF-α (Navarro-Sempere等,2021a)。已知这些对生活在火山附近的个体造成的改变与阿尔茨海默病等神经退行性疾病的病理生理学有关(Huat et al., 2019)。
另一方面,镉一旦被吸入,就会通过肺部进入血液。血脑屏障的内皮细胞存在一系列转运蛋白和受体,促进这种重金属从血液中进入(Branca等人,2020;thsamvenod et al., 2019)。镉一旦进入细胞,就会引起氧化应激,从而启动细胞抗氧化机制(Viaene et al., 2000)。在急性暴露于镉的情况下,这种机制足以保护中枢神经系统免受镉的进入,但在慢性暴露的情况下,抗氧化防御被削弱,增加血脑屏障的通透性,有利于更多的镉进入大脑(Shukla等人,1996)。据描述,由于星形胶质细胞是血脑屏障和突触之间的中间体,因此第一批受Cd进入中枢神经系统影响的细胞是星形胶质细胞。星形胶质细胞对慢性Cd暴露的反应会增加胶质原纤维酸性蛋白(GFAP)的表达(Khan et al., 2019),在保护中枢神经系统方面发挥更积极的作用。这一事实与先前发表的研究结果一致,在furas村捕获的小鼠的海马齿状回中,与居住在参考区域的小鼠相比,GFAP过表达(Navarro et al., 2021)。
细胞已经发展出一些机制来减少与重金属污染相关的损害,当解毒、代谢和/或储存机制不能抵消它们的吸收时,就会产生毒性效应。大多数重金属改变ROS和细胞抗氧化防御机制之间的微妙平衡,导致ROS浓度增加。这会在细胞中产生氧化应激环境,通常会导致细胞死亡(Balali-Mood et al., 2021)。从这个意义上说,金属硫蛋白是结合重金属的蛋白质,在防止这些金属的毒性作用中起着重要作用(Tokar etal ., 2013)。在神经系统层面,这些蛋白质存在于神经胶质细胞和神经元中,似乎对铅、汞和镉等重金属的神经毒性具有保护作用。有研究表明,金属硫蛋白可能是预防或治疗神经退行性疾病的一种方法(Juárez-Rebollar etal ., 2017;Manso et al., 2011;宫崎&浅沼,2023;Samuel et al., 2021)。与此相关,MT2A被认为是维持免疫稳态的关键角色(Jakovac等人,2013),并且在不同的神经退行性疾病中,如帕金森病(Miyazaki等人,2013),阿尔茨海默病(Chung等人,2010)或肌萎缩性侧索硬化症(Brandebura等人,2023),MT2A作为神经保护因子的参与已被描述。我们的结果显示一个强烈的表达MT-2A在不同地区的中枢神经系统在那些生活长期暴露于一个火山环境,这将表明一个排毒的过程是发生在中枢神经系统细胞由于不断的到来和积累重金属,如铅、Cd或Hg。MTs的差异表达两国人口研究表明,被描述的伊达尔戈et al ., 2001 Pb的存在,Cd或Hg能够诱导哺乳动物脑内金属硫蛋白的表达。因此,mt被认为是重金属介导的环境毒理学领域的生物标志物(Sakulsak, 2012)。此外,不仅金属本身会诱导这些mt的表达,而且以ROS和促炎细胞因子如TNF-α或IL-6的增加为标志的神经炎症环境也会诱导mt的过度表达(Kondoh等,2001;Penkowa et al., 2003)。如上所述,在Furnas村捕获的小鼠中,这种神经炎症环境的存在可能不仅是对重金属的反应,而且是对与它们共存的其他火山污染物引起的神经炎症的反应。参考区域(Rabo de Peixe)的动物也没有暴露在这些其他污染物中,因此,正如Navarro-Sempere等人(2021a)所报道的那样,它们没有表现出神经炎症过程,因此没有表现出MT表达的增加。
我们的发现强调了进一步研究火山空气污染及其对中枢神经系统的影响的必要性,因为它对全世界生活在火山地区的人口来说是一种重要但未知的风险。
作者的贡献。
YS、MG、AN-S、PM-P、AR、PV、RC、GL、L-G贡献了概念化;RC和AN-S贡献了野外工作和解剖;方法学由A N-S、PM-P、G-L和LG提供;数据分析由YS、MG、AN-S、GL和LG提供;写作-原稿准备,由AN-S、YS、MG、GL贡献;由AN-S, YS, MG, AR, PV,RC, PM-P,GL参与编写。
下载原文档:https://link.springer.com/content/pdf/10.1007/s10653-023-01722-5.pdf




